
Vsa vsebina iLive je pregledana ali preverjena, da se zagotovi čim večja dejanska natančnost.
Imamo stroge smernice za pridobivanje virov in samo povezave do uglednih medijskih strani, akademskih raziskovalnih institucij in, kadar je to mogoče, medicinsko pregledanih študij. Upoštevajte, da so številke v oklepajih ([1], [2] itd.) Povezave, ki jih je mogoče klikniti na te študije.
Če menite, da je katera koli naša vsebina netočna, zastarela ali drugače vprašljiva, jo izberite in pritisnite Ctrl + Enter.
Virus človeške imunske pomanjkljivosti (HIV)
Medicinski strokovnjak članka
Zadnji pregled: 04.07.2025
Sindrom pridobljene imunske pomanjkljivosti je bil leta 1981 v Združenih državah Amerike opredeljen kot specifična bolezen, ko je več mladih ljudi zbolelo za resnimi boleznimi, ki jih povzročajo mikroorganizmi, ki so bili za zdrave ljudi nepatogeni ali šibko patogeni. Študija imunskega statusa bolnikov je pokazala močno zmanjšanje števila limfocitov na splošno in zlasti T-pomožnih celic. To stanje so poimenovali AIDS (sindrom pridobljene imunske pomanjkljivosti). Način okužbe (spolni stik, prek krvi in njenih pripravkov) je kazal na nalezljivo naravo bolezni.
Povzročitelja aidsa sta leta 1983 neodvisno odkrila Francoz L. Montagnier, ki ga je poimenoval virus, povezan z limfoadenopatijo LAV, saj ga je odkril pri bolniku z limfadenopatijo, in Američan R. Gallo, ki je virus poimenoval HTLV-III (human T-lymphophopic Virus III): pred tem je odkril limfotropna virusa I in II.
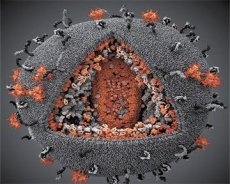
Primerjava lastnosti virusov LAV in HTLV-III je pokazala njuno identiteto, zato so virus leta 1986, da bi se izognili zmedi, poimenovali HIV (virus človeške imunske pomanjkljivosti ali HIV). HIV je okrogle oblike s premerom 110 nm. Virusna ovojnica ima obliko poliedra, sestavljenega iz 12 petkotnikov in 20 šestkotnikov. V središču in vogalih vsakega šestkotnika je molekula glikoziliranega proteina gpl20 (številka 120 označuje molekulsko maso proteina v kilodaltonih). Na površini viriona se nahaja skupno 72 molekul gpl20 v obliki svojevrstnih konic, od katerih je vsaka povezana z intramembranskim proteinom gp41. Ti proteini skupaj z dvojno lipidno plastjo tvorijo superkapsido (membrano) viriona.
Proteina gpl20 in gp41 nastaneta z razrezom predhodniškega proteina Env s celično proteazo. Protein gp41 tvori konico "stebla" tako, da se s svojo citoplazemsko domeno veže na matrični protein p17MA, ki se nahaja neposredno pod ovojnico. Molekule p17 med zorenjem viriona medsebojno delujejo in tvorijo ikozaeder pod ovojnico.
V osrednjem delu viriona protein p24 tvori stožčasto kapsido. Zoženi del kapside je s sodelovanjem proteina rb povezan z virionsko membrano. Znotraj kapside sta dve identični molekuli virusne genomske RNK. S svojimi 5' konci sta povezani z nukleokapsidnim proteinom p7NC. Ta protein je zanimiv, ker ima dva aminokislinska ostanka (motiva), bogata s cisteinom in histidinom, ki vsebujeta atom Zn – imenujemo jih »cinkovi prsti«, ker zajemajo molekule genomske RNK za vključitev v nastajajoče virione. Kapsida vsebuje tudi tri encime. Revertaza (RT) ali pol kompleks vključuje reverzno transkriptazo, RNazo H in DNA-odvisno DNA polimerazo. Revertaza je prisotna kot heterodimer p66/p51. Proteaza (PR) – p10, sproži in izvaja proces zorenja viriona. Integraza (IN) - p31 ali endonukleaza zagotavlja vključitev provirusne DNA v genom gostiteljske celice. Kapsida vsebuje tudi molekulo primerjske RNA (tRNA1"3).
Genom RNA v celici se s pomočjo reverzne transkriptaze pretvori v genom DNA (DNA provirus), ki ga sestavlja 9283 nukleotidnih parov. Na levi in desni strani ga omejujejo tako imenovane dolge terminalne ponovitve ali LTR: S'-LTR na levi in 3'-LTR na desni. LTR vsebujejo po 638 nukleotidnih parov.
Genom HIV sestavlja 9 genov, od katerih se nekateri na koncih prekrivajo (imajo več bralnih okvirjev) in imajo eksonintronsko strukturo. Nadzorujejo sintezo 9 strukturnih in 6 regulatornih proteinov.
Pomen LTR-jev za virusni genom je v tem, da vsebujejo naslednje regulatorne elemente, ki nadzorujejo njegovo delovanje:
- transkripcijski signal (promotorska regija);
- signal adicije poli-A;
- signal za omejitev;
- integracijski signal;
- signal pozitivne regulacije (TAR za protein TAT);
- negativni regulatorni element (NRE za protein NEF);
- mesto za vezavo primerja RNA (tRNA™3) za sintezo minus verige DNA na 3' koncu; signal na 5' koncu LTR, ki služi kot primer za sintezo plus verige DNA.
Poleg tega LTR vsebuje elemente, ki sodelujejo pri regulaciji spajanja mRNA, pakiranja molekul vRNA v kapsido (element Psi). Končno se med transkripcijo genoma v dolgih mRNA tvorita dva signala za protein REV, ki preklapljata sintezo beljakovin: CAR - za regulatorne beljakovine in CRS - za strukturne beljakovine. Če se protein REV veže na CAR, se sintetizirajo strukturne beljakovine; če ta ni prisoten, se sintetizirajo le regulatorne beljakovine.
Naslednji regulatorni geni in njihovi proteini igrajo še posebej pomembno vlogo pri uravnavanju delovanja virusnega genoma:
- TAT protein, ki izvaja pozitivno kontrolo virusne replikacije in deluje prek regulatorne regije TAR;
- Beljakovine NEV in VPU, ki negativno nadzorujejo replikacijo skozi regijo NRE;
- REV protein, ki izvaja pozitivno-negativno kontrolo. REV protein nadzoruje delo genov gag, pol, env in izvaja negativno regulacijo spajanja.
Tako je replikacija HIV pod trojnim nadzorom - pozitivnim, negativnim in pozitivno-negativnim.
Protein VIF določa kužnost novo sintetiziranega virusa. Povezan je s kapsidnim proteinom p24 in je v virionu prisoten v količini 60 molekul. Protein NEF je v virionu predstavljen z majhnim številom molekul (5-10), ki so morda povezane z ovojnico.
Protein VPR zavira celični cikel v fazi G2, sodeluje pri transportu predintegracijskih kompleksov v celično jedro, aktivira nekatere virusne in celične gene ter poveča učinkovitost replikacije virusa v monocitih in makrofagih. Lokacija proteinov VPR, TAT, REV in VPU v virionu ni bila ugotovljena.
Poleg lastnih beljakovin lahko virionska membrana vsebuje tudi nekatere beljakovine gostiteljske celice. Beljakovine VPU in VPR sodelujejo pri regulaciji virusne reprodukcije.
Antigenske variante virusa humane imunske pomanjkljivosti (HIV)
Virus humane imunske pomanjkljivosti (HIV) je zelo spremenljiv. Že iz telesa enega bolnika je mogoče izolirati seve virusa, ki se bistveno razlikujejo po antigenih lastnostih. Takšno spremenljivost olajšata intenzivno uničevanje celic CD4+ in močan odziv protiteles na okužbo z virusom HIV. Pri bolnikih iz Zahodne Afrike je bila izolirana nova oblika HIV, HIV-2, ki je biološko blizu HIV-1, a imunološko drugačna od njega. Homologija primarne strukture genomov teh virusov je 42 %. DNA provirus HIV-2 vsebuje 9671 bp, njegov LTR pa 854 bp. HIV-2 je bil nato izoliran tudi v drugih regijah sveta. Med HIV-1 in HIV-2 ni navzkrižne imunosti. Znani sta dve veliki obliki HIV-1: O (izstopajoča) in M (velika), slednja je razdeljena na 10 podtipov (AJ). V Rusiji kroži osem podtipov (AH).
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Mehanizem interakcije virusa HIV s celico
Ko virus prodre v telo, najprej napade celice, ki vsebujejo receptor CD4, specifičen zanj. Ta receptor je v velikih količinah prisoten v T-pomožnih celicah, v manjših količinah v makrofagih in monocitih, T-pomožne celice pa so še posebej občutljive na virus.
Virus humane imunske pomanjkljivosti (HIV) prepozna receptorje CD4 z uporabo svojega proteina gpl20. Proces interakcije HIV s celico poteka po naslednji shemi: adsorpcija, posredovana s receptorjem -> obložena jama -> obložen vezikel -> lizom. V njem se virionska membrana združi z lizosomsko membrano in nukleokapsida, osvobojena superkapside, vstopi v citoplazmo; na poti do jedra se uniči, pri čemer se sprostijo genomska RNA in z njo povezane komponente jedra. Nato reverzna transkriptaza sintetizira minus verigo DNA na virionski RNA, nato RNaza H uniči virionsko RNA, virusna DNA polimeraza pa sintetizira plus verigo DNA. Na koncih DNA provirusa se tvorita 5'-LTR in 3'-LTR. DNA provirus lahko nekaj časa ostane v jedru v neaktivni obliki, vendar se prej ali slej s pomočjo svoje integraze integrira v kromosom ciljne celice. V njem provirus ostane neaktiven, dokler danega T-limfocita ne aktivirajo mikrobni antigeni ali druge imunokompetentne celice. Aktivacijo celične transkripcije DNK uravnava poseben jedrski faktor (NF-kB). Je protein, ki veže DNK in se proizvaja v velikih količinah med aktivacijo in proliferacijo T-limfocitov in monocitov. Ta protein se veže na določena zaporedja celične DNK in podobna LTR zaporedja DNK provirusa ter inducira transkripcijo tako celične DNK kot DNK provirusa. Z indukcijo transkripcije DNK provirusa izvede prehod virusa iz neaktivnega stanja v aktivno in s tem iz persistentne okužbe v produktivno. Provirus lahko ostane v neaktivnem stanju zelo dolgo časa. Aktivacija virusa je kritičen trenutek v njegovi interakciji s celico.
Od trenutka, ko virus prodre v celico, se začne obdobje okužbe z virusom HIV - stanje virusnonoštva, ki lahko traja 10 let ali več; in od trenutka, ko se virus aktivira, se začne bolezen - AIDS. S pomočjo svojih regulatornih genov in njihovih produktov se virus začne aktivno razmnoževati. Beljakovina TAT lahko poveča hitrost razmnoževanja virusa za 1000-krat. Virusna transkripcija je kompleksna. Vključuje nastanek tako polne dolžine kot subgenomske mRNA, spajanje mRNA in nato sintezo strukturnih in regulatornih beljakovin.
Sinteza strukturnih beljakovin poteka na naslednji način. Najprej se sintetizira prekurzorski poliprotein Pr55Gag (beljakovina z molekulsko maso 55 kDa). Vsebuje 4 glavne domene: matriks (MA), kapsido (CA), nukleokapsido (NC) in domeno rb, iz katere se zaradi razrezovanja Pr55Gag z virusno proteazo (samo-razreže iz druge prekurzorske beljakovine, Gag-Pol) tvorijo strukturne beljakovine p17, p24, p7 in rb. Nastanek poliproteina Pr55Gag je glavni pogoj za nastanek virusnih delcev. Prav ta beljakovina določa program morfogeneze virionov. Ta zaporedno vključuje faze transporta poliproteina Gag do plazemske membrane, interakcije z njo in interakcije med beljakovinami med nastankom virusnega delca in njegovim brstenjem. Pr55Gag se sintetizira na prostih poliribosomih; beljakovinske molekule se transportirajo do membrane, kjer se zasidrajo s svojimi hidrofobnimi regijami. Domena CA igra glavno vlogo pri ustvarjanju nativne konformacije proteina Gag. Domena NC zagotavlja vključitev (s pomočjo svojih "cinkovih prstov") dveh molekul genomske RNK v sestavo nastajajočega virusnega delca. Molekula poliproteina se sprva dimerizira zaradi interakcije matričnih domen. Nato se dimeri zaradi interakcije domen CA in NC združijo v heksamerne (s 6 enotami) komplekse. Nazadnje se heksameri, ki se združijo na svojih stranskih površinah, tvorijo nezrele sferične virione, znotraj katerih se nahaja genomska virusna RNK, ki jo zajame domena NC.
Drug predhodniški protein, Prl60Gag-Pol (protein z molekulsko maso 160 kDa), se sintetizira kot posledica premika bralnega okvirja ribosoma med translacijo 3'-konca gena gag v regiji, ki se nahaja tik pred regijo, ki kodira protein rb. Ta poliprotein Gag-Pol vsebuje nepopolno zaporedje proteina Gag (1-423 aminokislin) in zaporedja Pol, ki vključujejo domene PR, RT in IN. Molekule poliproteina Gag-Pol se prav tako sintetizirajo na prostih poliribosomih in se prenesejo v plazemsko membrano. Poliprotein Prl60Gagpol vsebuje vsa mesta medmolekularnih interakcij in mesta vezave na membrano, ki so lastna poliproteinu Gag. Zato se molekule poliproteina Gag-Pol združijo z membrano in se skupaj z molekulami Gag vključijo v nastajajoče virione, kar povzroči pojav aktivne proteaze in začetek procesa zorenja virionov. Proteaza HIV-1 je zelo aktivna le v obliki dimera, zato je za njeno samoizločitev iz Prl60Gag-Pol potrebna dimerizacija teh molekul. Zorenje virionov je sestavljeno iz dejstva, da sproščena aktivna proteaza reže prl60Gag-Pol in Gag55 na mestih, ki jih prepozna; nastanejo proteini p17, p24, p7, p6, revertaza, integraza in pride do njihove povezave v virusno strukturo.
Protein Env se sintetizira na ribosomih, povezanih z membranami endoplazemskega retikuluma, nato se glikozilira, celična proteaza ga razreže na gp120 in gp41 ter prenese na celično površino. V tem primeru gp41 prodre skozi membrano in se veže na matrične domene molekule proteina Gag, povezane z notranjo površino membrane. Ta povezava se ohrani v zrelem virionu.
Sestavljanje virusnih delcev torej sestavljajo agregacija prekurzorskih beljakovin in pripadajočih molekul RNA na plazemski membrani gostiteljske celice, nastanek nezrelih virionov in njihovo sproščanje z brstenjem s celične površine. Med brstenjem se virion obda s celično membrano, v katero so vgrajene molekule gp41 in gp120. Med brstenjem ali morda po sproščanju virionov pride do njihovega zorenja, ki se izvaja s pomočjo virusne proteaze in je sestavljeno iz proteolitične razgradnje prekurzorskih beljakovin Pr55Gag in Prl60Gag-Pol v beljakovine zrelega virusa in njihovega združevanja v določene strukturne komplekse. Vodilno vlogo v procesih virusne morfogeneze ima prekurzorski poliprotein Pr55Gag, ki organizira in sestavlja nezreli virion; proces njegovega zorenja zaključi specifična virusna proteaza.
Vzroki za imunsko pomanjkljivost
Eden glavnih vzrokov za imunsko pomanjkljivost pri okužbi z virusom HIV je množična smrt T-pomožnih celic. Pojavi se kot posledica naslednjih dogodkov. Prvič, T-pomožne celice, okužene z virusom, umrejo zaradi apoptoze. Domneva se, da so pri bolnikih z aidsom replikacija virusa, apoptoza in zmanjšanje števila T-pomožnih celic medsebojno povezani. Drugič, T-ubijalci prepoznajo in uničijo T-celice, okužene z virusom ali ki nosijo adsorbirane molekule gpl20, pa tudi T-pomožne celice, okužene z virusom, in tiste, ki niso okužene z virusom, ki tvorijo simplaste (sincicij), sestavljene iz več deset celic (nekatere od njih umrejo zaradi razmnoževanja virusov v njih). Zaradi uničenja velikega števila T-pomožnih celic se zmanjša izražanje membranskih receptorjev v B-limfocitih za interlevkin-2, moti se sinteza različnih interlevkinov (rastni faktorji in diferenciacija B-limfocitov - IL-4, IL-5, IL-6 itd.), kar povzroči moteno delovanje sistema T-ubijalcev. Aktivnost komplementa in makrofagnega sistema je zavirana. Makrofagi in monociti, okuženi z virusom, dolgo ne umrejo, vendar virusa ne morejo odstraniti iz telesa. Končno se zaradi strukturne in antigenske podobnosti gpl20 z receptorji nekaterih epitelijskih celic v telesu (vključno s trofoblastnimi receptorji, ki posredujejo pri prenosu virusa HIV po presaditvi) sintetizirajo protireceptorska protitelesa s širokim spektrom delovanja. Takšna protitelesa lahko blokirajo različne celične receptorje in otežijo potek bolezni z avtoimunskimi motnjami. Posledica okužbe z virusom HIV je poraz vseh glavnih povezav imunskega sistema. Takšni bolniki postanejo nemočni pred najrazličnejšimi mikroorganizmi. To vodi v razvoj oportunističnih okužb in tumorjev. Pri bolnikih z okužbo z virusom HIV se poveča tveganje za razvoj vsaj treh vrst raka: Kaposijevega sarkoma; karcinoma (vključno s kožnim rakom); B-celičnega limfoma, ki nastane zaradi maligne transformacije B-limfocitov. Vendar pa HIV ni le limfocitotropen, ampak tudi nevrotropen. V celice centralnega živčnega sistema (astrocite) prodre tako z endocitozo, ki jo posredujejo receptorji, kot tudi s fagocitozo limfoblastov, okuženih z virusom, s strani astrocitov. Ko virus interagira z astrociti, se tvorijo tudi simplasti, ki olajšajo širjenje patogena po medceličnih kanalih. Virus lahko dolgo časa vztraja v makrofagih in monocitih, zato ti služijo kot njegov rezervoar in distributer v telesu, saj lahko prodrejo v vsa tkiva. Okuženi makrofagi igrajo pomembno vlogo pri vnosu virusa HIV v centralni živčni sistem in njegovi poškodbi. Pri 10 % bolnikov so primarni klinični sindromi povezani z okvaro centralnega živčnega sistema in se kažejo kot demenca. Tako so za ljudi, okužene z virusom HIV, značilne 3 skupine bolezni - oportunistične okužbe,tumorske bolezni in poškodbe osrednjega živčnega sistema.
Epidemiologija okužbe z virusom HIV
Vir okužbe z virusom HIV je samo oseba – bolna oseba ali nosilec virusa. Virus humane imunske pomanjkljivosti (HIV) se nahaja v krvi, spermi, cervikalni tekočini; pri doječih materah – v materinem mleku. Okužba se pojavi spolno, s krvjo in njenimi pripravki, pa tudi z matere na otroka pred, med in po porodu. Primeri okužbe z virusom s hrano, pijačo in piki žuželk niso znani.
Zasvojenost z drogami prispeva k širjenju aidsa. Incidenca okužb z virusom HIV vsako leto narašča. Po podatkih Svetovne zdravstvene organizacije (WHO) je bilo od leta 1980 do 2000 z virusom HIV okuženih 58 milijonov ljudi. Samo leta 2000 se je po vsem svetu okužilo 5,3 milijona ljudi, zaradi aidsa pa je umrlo 3 milijone ljudi. 1. januarja 2004 je bilo v Rusiji registriranih 264 tisoč okuženih z virusom HIV. Polovica okuženih z virusom HIV umre v 11–12 letih od trenutka okužbe. V začetku leta 2004 je od vsakih 100 tisoč državljanov Rusije približno 180 živelo z diagnozo "okužba z virusom HIV". Predvideva se, da bo s to stopnjo obolevnosti do leta 2012 skupno število okuženih z virusom HIV v Rusiji znašalo 2,5–3 milijone ljudi. Kompleksnost boja proti okužbi z virusom HIV je odvisna od več razlogov: prvič, ni učinkovitih metod zdravljenja in specifične preventive; drugič, inkubacijska doba za okužbo z virusom HIV lahko preseže 10 let. Njegovo trajanje je odvisno od trenutka aktivacije T-limfocita in DNA provirusa, ki ga vsebuje njegov kromosom. Še vedno ni jasno, ali je vsak, okužen z virusom, obsojen na AIDS ali pa je možno dolgotrajno prenašanje virusa brez bolezni (kar se zdi malo verjetno). Nazadnje obstaja več virusov človeške imunske pomanjkljivosti (HIV-1, HIV-2), katerih antigenske razlike preprečujejo nastanek navzkrižne imunosti. Odkritje virusa imunske pomanjkljivosti pri opicah (SIV) je osvetlilo vprašanje izvora HIV. SIV je po svoji genomski organizaciji podoben HIV, vendar se bistveno razlikuje po nukleotidnem zaporedju. HIV-2 ima po svojih seroloških lastnostih vmesni položaj med HIV-1 in SIV, po nukleotidnem zaporedju pa je bližje SIV. V zvezi s tem je V. M. Ždanov predlagal, da virusi HIV-1, HIV-2 in SIV izvirajo iz skupnega prednika. Po mnenju R. Galla je možno, da je eden od SIV-ov nekako vstopil v človeško telo, kjer je doživel vrsto mutacij, kar je povzročilo nastanek HIV-1, HIV-2 in njegovih drugih oblik.
Simptomi okužbe z virusom HIV
Virus humane imunske pomanjkljivosti ima nekatere značilnosti, ki v veliki meri določajo patogenezo bolezni. Virus ima zelo visoko stopnjo razmnoževanja, ki jo določajo njegovi regulatorni elementi (v aktivni fazi se v 5 minutah sintetizira do 5000 virionov). Zaradi prisotnosti fuzijskega proteina (gp41) virus zaradi fuzije okuženih in neokuženih T-pomožnih celic povzroči nastanek obsežnih sincicijskih struktur, kar povzroči njihovo množično smrt. Molekule proteina gpl20, ki nastanejo v velikih količinah, prosto krožijo v krvi in se vežejo na receptorje neokuženih T-pomožnih celic, zaradi česar jih T-ubijalci prav tako prepoznajo in uničijo. Virus se lahko širi po medceličnih kanalih iz celice v celico, v tem primeru pa postane težko dostopen protitelesom.
Klinična merila za okužbo z virusom HIV
Pri odraslih se okužba z virusom HIV diagnosticira, če imajo vsaj dva resna simptoma v kombinaciji z vsaj enim blagim simptomom in če ni drugih znanih vzrokov za imunsko pomanjkljivost (rak, prirojena imunska pomanjkljivost, hudo stradanje itd.). Resni simptomi vključujejo:
- izguba teže za 10 % ali več;
- dolgotrajno vročinsko stanje, občasno ali stalno;
- kronična driska.
Manjši simptomi: vztrajen kašelj, generaliziran dermatitis, ponavljajoči se herpes zoster, oralna in faringealna kandidoza, kronični herpes simpleks, generalizirana limfadenopatija. Diagnoza aidsa se postavi le ob prisotnosti Kaposijevega sarkoma, kriptokoknega meningitisa, pnevmocistične pljučnice. Na klinično sliko bolezni vpliva spremljajoča oportunistična okužba.
Metode gojenja virusa humane imunske pomanjkljivosti (HIV)
HIV-1 in HIV-2 lahko gojimo v celicah samo enega klona limfocitov TCV4 - H9, pridobljenega iz levkemičnih limfocitov TCV4. Za te namene se lahko uporabijo tudi monoslojne kulture astrocitnih celic, v katerih se HIV-1 dobro razmnožuje. Med živalmi so za HIV-1 dovzetni šimpanzi.
Odpornost virusa v zunanjem okolju je nizka. Pod vplivom sončne svetlobe in UV-sevanja umre, pri 80 °C se uniči v 30 minutah, pri obdelavi z običajno uporabljenimi razkužili pa v 20–30 minutah. Za razkuževanje materiala, ki vsebuje viruse, je potrebno uporabiti mikobaktericidna razkužila, saj so učinkovita proti mikroorganizmom z najvišjo odpornostjo.
Laboratorijska diagnostika okužbe z virusom HIV
Glavna metoda za diagnosticiranje virusnonosilstva in okužbe z virusom HIV je encimski imunski test. Ker pa ima gpl20 strukturno in antigensko podobnost z receptorji nekaterih človeških celic, vključno z receptorji, ki prenašajo imunoglobuline skozi epitelijske celice sluznic, se lahko v telesu pojavijo protitelesa, sorodna protitelesom proti gpl20. V tem primeru so lahko rezultati ELISA lažno pozitivni. Zato se vsi pozitivno reagirajoči serumi preiskovancev dodatno analizirajo z metodo imunoblotiranja oziroma Western blotiranja. Ta metoda temelji na identifikaciji preiskovanih protiteles po njihovi elektroforetski ločitvi in naknadnem testiranju z označenimi protitelesi proti vrsti. Virološka metoda se redko uporablja zaradi kompleksnosti gojenja virusa. Klon limfocitov H9 se uporablja za pridobivanje virusnih antigenov - potrebnih komponent diagnostičnih testnih sistemov. Metoda CPR omogoča odkrivanje virusa v zgodnji fazi viremije.
Zdravljenje okužbe z virusom HIV
Treba je najti ali sintetizirati zdravila, ki učinkovito zavirajo aktivnost reverzne transkriptaze (revertaze) ali virusne proteaze. Preprečevala bi nastanek DNA provirusa in/ali zavirala znotrajcelično razmnoževanje virusa. Sodobna strategija zdravljenja bolnikov, okuženih z virusom HIV, temelji na načelu kombinirane uporabe zdravil, ki zavirajo virusno proteazo (eno od zdravil) in reverzno transkriptazo (2 različni zdravili) - kombinirana (trojna) terapija. V Rusiji se za zdravljenje bolnikov, okuženih z virusom HIV, priporoča kombinirana uporaba dveh domačih zdravil: fosfazida in kriksivana, ki specifično zavirata razmnoževanje virusa HIV v zgodnjih in poznih fazah razmnoževanja, zlasti pri zmanjšani aktivnosti azidotimidina.
Problem specifične profilakse je potreba po ustvarjanju cepiva, ki bi zagotovilo nastanek učinkovite celično posredovane imunosti, ki temelji na virusno specifičnih citotoksičnih limfocitih, brez kakršne koli pomembne produkcije protiteles. Takšno imunost zagotavljajo Thl pomočniki. Možno je, da protitelesa, vključno s tistimi, ki nevtralizirajo virus, niso le neučinkovita pri zatiranju okužbe z virusom HIV, temveč v veliki meri zavirajo celično posredovano imunost. Zato mora cepivo proti HIV izpolnjevati predvsem dve glavni zahtevi: a) biti popolnoma varno in b) spodbujati aktivnost T-citotoksičnih limfocitov. Preučuje se učinkovitost različnih variant cepiva, pridobljenih iz ubitih (inaktiviranih) virusov in iz posameznih antigenov z visokimi zaščitnimi lastnostmi. Takšne antigene je mogoče izolirati iz samih virionov ali sintetizirati kemično. Predlagano je bilo cepivo, ustvarjeno na podlagi metod genskega inženiringa. Gre za rekombinantni virus vakcinije, ki nosi gene HIV, odgovorne za sintezo antigenov z močnimi imunogenimi lastnostmi. Vprašanje učinkovitosti teh cepiv zahteva precej časa zaradi dolge inkubacijske dobe okužbe z virusom HIV in velike variabilnosti patogena. Ustvarjanje zelo učinkovitega cepiva proti virusu HIV je nujen temeljni problem.

